« The Lancet », qui démolit le traitement de Raoult, publiait une étude élogieuse sur les effets positifs et le peu de dangerosité de la chloroquine
… en 2003
La chloroquine est une 9-aminoquinoléine connue depuis 1934. Outre ses effets antipaludiques bien connus, le médicament possède des propriétés biochimiques intéressantes qui pourraient être appliquées contre certaines infections virales. La chloroquine exerce des effets antiviraux directs, en inhibant les étapes de la réplication de plusieurs virus dépendant du pH, y compris les membres des flavivirus, des rétrovirus et des coronavirus. Ses effets les mieux étudiés sont ceux contre la réplication du VIH, qui sont actuellement testés dans des essais cliniques. En outre, la chloroquine a des effets immunomodulateurs, supprimant la production/libération du facteur de nécrose tumorale α et de l’interleukine 6, qui servent de médiateurs pour les complications inflammatoires de plusieurs maladies virales. Nous passons en revue les informations disponibles sur les effets de la chloroquine sur les infections virales, ce qui soulève la question de savoir si ce vieux médicament pourrait connaître un regain d’intérêt dans la gestion clinique des maladies virales telles que le sida et le syndrome respiratoire aigu sévère, qui affligent l’humanité à l’ère de la mondialisation.
La chloroquine est une 9-aminoquinoléine connue depuis 1934. Spécifiquement synthétisée pour être utilisée comme agent antipaludique, la chloroquine s’est par la suite avérée avoir des propriétés immunomodulatrices qui ont encouragé son application dans le traitement de maladies auto-immunes telles que la polyarthrite rhumatoïde. Pour cette pathologie spécifique, la chloroquine et son hydroxy-analogue, l’hydroxychloroquine, ont représenté une contribution valable aux outils pharmacologiques disponibles, puisqu’ils se sont révélés capables de ralentir la progression de la maladie tout en présentant une toxicité limitée.
Malheureusement, la chloroquine est progressivement écartée de la thérapie et de la prophylaxie antipaludiques, en raison de l’émergence continue de souches de Plasmodium falciparum résistantes à la chloroquine. Cependant, la tolérabilité, le faible coût et les propriétés immunomodulatrices de la chloroquine/hydroxychloroquine sont associés à des effets biochimiques qui suggèrent une utilisation potentielle dans les infections virales, dont certains symptômes peuvent résulter de la réponse inflammatoire. Nous nous demandons si ce vieux médicament dont le composé parent, la quinine, a été isolé à la fin du 19ème siècle de l’écorce du quinquina tropical, peut connaître un renouveau dans la gestion clinique des maladies virales de l’ère de la mondialisation. […]
Mécanismes généraux de l’inhibition virale par la chloroquine
La chloroquine/hydroxychloroquie peut entraver la réplication de plusieurs virus en interagissant avec l’entrée virale à médiation endosomique ou les stades tardifs de réplication des virus enveloppés (figure 1).
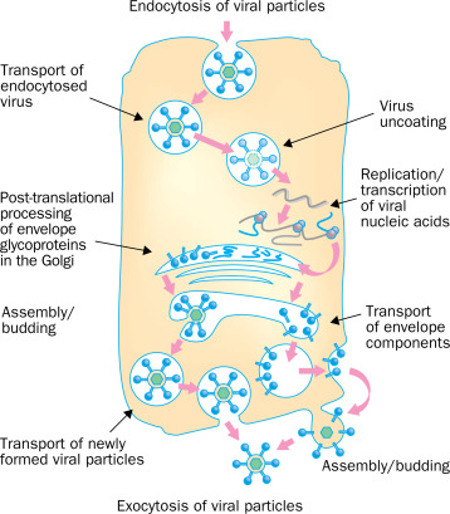
Figure 1 – Etapes de la réplication de différents virus affectés par la chloroquine (marquées par des rectangles rouges). La chloroquine inhibe la réplication de différents virus, que ce soit au stade précoce ou tardif de la réplication virale.
Interaction entre les virus à médiation endosomiale
Certains virus pénètrent dans leurs cellules cibles par endocytose. Ce processus dirige le virus vers le compartiment lysosomal où le faible pH, associé à l’action des enzymes, perturbe la particule virale, libérant ainsi l’acide nucléique infectieux et, dans plusieurs cas, les enzymes nécessaires à la réplication virale. Il a été démontré que la chloroquine inhibe différents virus dont l’entrée dépend du pH, tels que le virus de la maladie de Borna, le virus de la MVMp de la souris et le virus de la leucose aviaire. Le rapport selon lequel la chloroquine inhibe le dessèchement du virus de l’hépatite A, bloquant ainsi tout son cycle de réplication, présente un intérêt particulier pour la pathologie humaine. […]
Effets de la chloroquine sur le système immunitaire
L’accumulation de chloroquine/hydroxychloroquine dans les lymphocytes et les macrophages lui confère des propriétés anti-inflammatoires et a conduit à son utilisation clinique dans des affections telles que la polyarthrite rhumatoïde, le lupus érythémateux et la sarcoïdose, cette dernière étant caractérisée par une surproduction du facteur de nécrose tumorale α (TNFα) par les macrophages alvéolaires. La chloroquine/hydroxychloroquine réduit la sécrétion de ces cytokines pro-inflammatoires et en particulier TNFα, comme le montre une lignée cellulaire de macrophages murins, et de cellules primaires telles que les macrophages péritonéaux de souris, les cellules mononucléaires du sang périphérique humain, et le sang total humain. Plusieurs mécanismes ont été évoqués pour expliquer l’inhibition de la production de TNFα par les monocytes-macrophages induite par la chloroquine/hydroxychloroquine : perturbation de l’homéostasie du fer cellulaire, inhibition de l’expression de l’ARNm de TNFα , inhibition à un stade prétraductionnel par un mécanisme non lysosomotropique ou à un stade post-traductionnel en bloquant la conversion de pro-TNFα associé aux cellules en une forme mature soluble. Outre l’inhibition de la production de TNFα par des monocytes-macrophages stimulés, la chloroquine diminue également l’expression de surface des récepteurs TNFα dans les lignées cellulaires monocytaires humaines et, par conséquent, la signalisation TNFα médiée par les récepteurs.
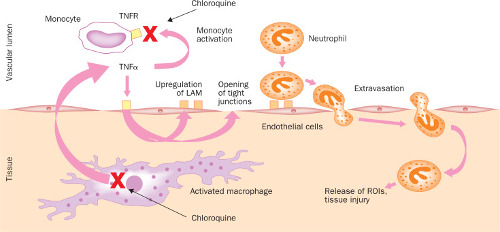
Figure 2 – Effets de la chloroquine sur le système immunitaire.
TNFα est produit par des monocytes/macrophages activés. Parmi ses multiples fonctions, elle aide à activer les monocytes au repos et favorise l’extravasation des neutrophiles en ouvrant des jonctions étroites entre les cellules endothéliales vasculaires humaines et en régulant à la hausse les molécules d’adhésion des leucocytes (LAM). La chloroquine diminue la production de TNFα et régule à la baisse les récepteurs 1 et 2 (TNFR) de TNFα à la surface des cellules monocytes, ce qui entraîne finalement une diminution de l’activation des monocytes ainsi qu’une diminution de l’extravasation des leucocytes. Les croix rouges marquent les étapes directement inhibées par la chloroquine.
Considérations de sécurité
Les études examinées ici montrent que la chloroquine/hydroxychloroquine a des effets antiviraux in vitro et des propriétés anti-inflammatoires qui peuvent être intéressantes dans les infections virales associées à une inflammation et/ou une activation immunitaire. Avant d’analyser les effets potentiels d’un médicament sur une maladie, des critères de sécurité doivent être remplis, afin d’estimer le rapport risques/bénéfices.
La chloroquine/hydroxychloroquie a un profil de toxicité bien étudié. L’utilisation de ce médicament pendant un demi-siècle dans la thérapie de la malaria démontre la sécurité de l’administration aiguë de chloroquine aux êtres humains. L’utilisation de la chloroquine/hydroxychloroquine dans les maladies rhumatismales et pour la prophylaxie antipaludéenne a montré une faible incidence d’effets indésirables lors de l’administration chronique de ce médicament pendant des périodes pouvant aller jusqu’à quelques années. Dans ces cas, l’effet toxique le plus grave est une rétinopathie maculaire, qui dépend de la dose cumulative plutôt que de la dose quotidienne, et des dommages permanents peuvent être évités grâce à une surveillance visuelle régulière pendant le traitement. Une étude récente a fourni des résultats encourageants sur la sécurité d’un dosage élevé du médicament (jusqu’à 500 mg de chloroquine base par jour) même pendant la grossesse.
Nous concluons que l’administration de chloroquine/hydroxychloroquine présente une toxicité limitée et bien évitable et peut donc entraîner un faible rapport risques/bénéfices, du moins lorsqu’elle est utilisée dans des conditions mettant la vie en danger.
Dorénavant, nous discuterons de l’utilité potentielle de ce vieux médicament dans le traitement de deux maladies infectieuses qui représentent une menace sérieuse pour la santé publique à l’ère de la mondialisation, le SIDA et le syndrome respiratoire aigu sévère (SRAS). Ces maladies sont toutes deux causées par des virus à ARN enveloppés et partagent certaines manifestations cliniques qui sont susceptibles d’être médiées par des réactions immunitaires de l’hôte.
Effets sur l’infection par le VIH
Les effets anti-VIH de la chloroquine
Dans des conditions d’essai destinées à imiter le mieux possible les situations cliniques, la chloroquine/hydroxychloroquine est capable d’inhiber le VIH in vitro. Cette capacité a été démontrée soit en surchargeant les cellules avec des concentrations élevées de chloroquine/hydroxychloroquine avant l’infection, de manière à imiter l’accumulation de médicament qui se produit dans les tissus des patients soumis à un traitement chronique, soit en gardant les cellules infectées par le VIH en incubation constante avec des concentrations de chloroquine détectées dans le sang entier des individus traités de manière chronique avec ce médicament. L’activité anti-VIH de la chloroquine a été démontrée non seulement dans des modèles de lignées cellulaires, mais aussi dans les lymphocytes du sang périphérique et les monocytes, des modèles de culture cellulaire dans lesquels l’absorption cellulaire de la chloroquine est plus proche des conditions survenant in vivo. Dans ces conditions, il a été possible d’obtenir des niveaux d’inhibition de la réplication virale supérieurs à 90 %. Deux essais cliniques de phase II ont rapporté que l’hydroxychloroquine a une certaine activité antivirale in vivo. Le premier essai était une petite étude pilote randomisée, en double aveugle et contrôlée par placebo, menée sur 40 patients (20 patients par bras), dont 27 n’avaient jamais reçu de traitement antirétroviral.

L’administration d’hydroxychloroquine pendant 8 semaines a entraîné une réduction moyenne de 0 à 6 log du nombre de copies de l’ARN du VIH-1 dans le plasma (p=0-02) ainsi qu’une diminution des concentrations d’interleukine 6, tandis que le placebo n’a eu aucun effet sur l’ARN du VIH-1 et l’interleukine 6. Le deuxième essai était également un petit essai randomisé en double aveugle, comparant l’efficacité de l’hydroxychloroquine à celle de la zidovudine en monothérapie pendant 16 semaines chez 72 patients, dont 64 n’avaient jamais reçu de traitement antirétroviral (35 dans le groupe hydroxychloroquine et 37 dans le groupe zidovudine). L’hydroxychloroquine a de nouveau réduit de manière significative le nombre de copies d’ARN VIH-1 dans le plasma/ml (base 39 456 [31 000] ; post-traitement 16 434 [11 373] ; réduction log moyenne 0-4 ; p=0-02), mais moins que la zidovudine (base 42 709 [33 050] ; post-traitement 11 228 [7459] ; réduction log moyenne 0-6 ; p=0-01). Étant donné que huit des 37 personnes du groupe zidovudine, mais aucune des 35 personnes du groupe hydroxychloroquine, ont présenté une augmentation des niveaux d’ARN du VIH-1 et des niveaux de virus en culture pendant le traitement, ces données sont conformes à l’hypothèse selon laquelle la résistance à l’hydroxychloroquine pourrait ne pas se développer facilement, contrairement au développement bien connu de la résistance à la monothérapie par d’autres antirétroviraux comme la zidovudine. Les résultats d’essais cliniques plus importants seront nécessaires pour une analyse précise de toute divergence éventuelle entre les effets de la chloroquine in vitro et chez les personnes infectées par le VIH.
Certains d’entre nous ont récemment montré que la chloroquine, à des concentrations non toxiques et cliniquement réalisables, a une activité in vitro contre des isolats primaires appartenant à différentes clades du VIH-1 et du VIH-2. Le mécanisme des effets anti-VIH de la chloroquine/hydroxychloroquine est une réduction de l’infectivité des virions nouvellement produits (examiné dans Savarino et al2). Les effets antiviraux de la chloroquine sont associés à la production réduite de l’épitope 2G12 fortement glycosylé, qui est situé à la surface de la glycoprotéine d’enveloppe gp120 et qui est fondamental pour l’infectivité du virus. Ces effets sont probablement attribués à l’augmentation du pH dans le TGN, qui altère la fonction des glycosyl-transférases impliquées dans le traitement post-traductionnel des glycoprotéines du VIH. La glycosylation du VIH peut donc représenter une nouvelle cible pour la thérapie antirétrovirale. Comme la glycosylation de l’enveloppe virale est médiée par des enzymes cellulaires, son inhibition peut expliquer le large spectre de l’activité anti-VIH in vitro de la chloroquine contre tous les principaux sous-types de VIH-1 et VIH-2. L’effet de la chloroquine/hydroxychloroquine sur les enzymes cellulaires plutôt que virales peut également entraîner une faible propension au développement de la résistance. […]
Hypothèse : le cas du SRAS
En se basant sur les effets de la chloroquine/hydroxychloroquine sur plusieurs virus enveloppés et sur l’activation immunitaire, nous émettons l’hypothèse que ce médicament pourrait être d’une certaine utilité pour la gestion clinique du SRAS. Actuellement, toute tentative de traitement de cette maladie avec des médicaments antiviraux connus – à savoir la ribavirine et l’oseltamivir – n’a pas été concluante. Les corticostéroïdes peuvent être d’une certaine utilité pour contrôler la réponse inflammatoire au niveau des poumons mais peuvent également provoquer une immunodépression non contrôlée entraînant une surinfection pulmonaire.
L’agent causal du SRAS a récemment été décrit comme un nouveau coronavirus. Des études récentes soutiennent l’idée que les coronaviridés infectent leurs cellules cibles par une voie endocytaire et que la chloroquine pourrait inhiber leur réplication. Les cellules infectées par le coronavirus humain HCoV-229E et traitées au nocodazole (un agent de microtubules dépolymérisation qui bloque le transport des endosomes précoces à tardifs) ont produit des quantités réduites d’antigènes HCoV-229E. Ce résultat indique que le transport endosomal est nécessaire pour l’infection par HCoV-229E. Les cellules traitées à la chloroquine ont exprimé des quantités moindres d’antigènes HCoV-229E. Les données préliminaires obtenues de notre groupe confirment ces rapports et montrent que la chloroquine inhibe puissamment la réplication d’un coronavirus canin à des concentrations thérapeutiquement atteignables (C Buonavoglia et al, Université de Bari, Italie ; non publié). Bien que le coronavirus du SRAS soit distinct avec des caractéristiques uniques, il est tentant de se demander si la chloroquine pourrait également affecter la réplication du coronavirus du SRAS.
Les propriétés anti-inflammatoires de la chloroquine/hydroxychloroquine devraient également être prises en compte. L’aggravation clinique des personnes atteintes du SRAS en semaine 2 n’est apparemment pas liée à une réplication incontrôlée du coronavirus du SRAS mais pourrait être liée à des dommages immunopathologiques. Un modèle prenant en compte le rôle des cytokines pro-inflammatoires pourrait aider à interpréter cet événement. Ce point de vue découle des effets du coronavirus respiratoire porcin (CVP), qui partage avec le coronavirus du SRAS la capacité de provoquer une maladie présentant des caractéristiques histopathologiques et une symptomatologie similaires. Le PRCV induit de graves lésions pulmonaires par des mécanismes à médiation immunitaire – c’est-à-dire probablement par une augmentation des concentrations de cytokines pro-inflammatoires telles que TNFα et l’interleukine 6, dont le rôle dans l’induction de lésions pulmonaires a été prouvé à l’aide de vecteurs adénoviraux dans des modèles animaux. Pour ces raisons, nous pensons que les associations entre les concentrations de TNFα et d’interleukine 6 et la gravité de la maladie devraient également être testées dans des échantillons stockés de patients humains atteints du SRAS. Si des résultats de confirmation sont obtenus, il serait alors raisonnable d’envisager la chloroquine/hydroxychloroquine pour supprimer la production de TNFα et d’interleukine 6. À cette fin, les efforts visant à développer un modèle animal pour le SRAS seraient les bienvenus. Un tel modèle contribuerait à clarifier la composante immuable des symptômes de la maladie ainsi qu’à tester la chloroquine et d’autres médicaments immunomodulateurs. Ces études pourraient également jeter les bases de la suggestion d’envisager l’utilisation de la chloroquine pour le traitement d’autres infections virales impliquant une immunopathologie.
yogaesoteric
28 juin 2020
