CRIIGEN — Note d’expertise grand public sur les vaccins ayant recours aux technologies de modifications génétiques des organismes (II)
Nous reproduisons ici de la « Note d’expertise grand public sur les vaccins ayant recours aux technologies OGM » écrite et publiée en septembre 2020 par le Dr Christian Vélot, généticien moléculaire à l’Université Paris-Saclay et Président du Conseil scientifique du CRIIGEN.
Lisez la première partie de cet article
IV. Analyse des risques liés à chaque type de candidat vaccin contre la Covid-19
1. Vaccins inactivés
 Le fait qu’un vaccin utilise un virus inactivé ne signifie pas une absence de risques. L’effet immunisant de ce type de vaccins est moindre qu’avec un virus atténué. Il nécessite donc des injections répétées et l’ajout d’adjuvants, présentant potentiellement des effets toxiques, pour potentialiser l’effet immunogène (cf. partie II). Une étude suisse de 2004 a montré qu’un vaccin inactivé de la grippe, en administration intra-nasale, provoquait chez un grand nombre de patients la paralysie de Bell (paralysie de l’ensemble des muscles du visage), sans qu’on en connaisse toutefois la raison exacte. Ce vaccin a depuis été retiré.
Le fait qu’un vaccin utilise un virus inactivé ne signifie pas une absence de risques. L’effet immunisant de ce type de vaccins est moindre qu’avec un virus atténué. Il nécessite donc des injections répétées et l’ajout d’adjuvants, présentant potentiellement des effets toxiques, pour potentialiser l’effet immunogène (cf. partie II). Une étude suisse de 2004 a montré qu’un vaccin inactivé de la grippe, en administration intra-nasale, provoquait chez un grand nombre de patients la paralysie de Bell (paralysie de l’ensemble des muscles du visage), sans qu’on en connaisse toutefois la raison exacte. Ce vaccin a depuis été retiré.
Par ailleurs, plusieurs études ont révélé une augmentation du risque d’infection (par le même virus ou d’autres) suite à une vaccination avec des vaccins inactivés. C’est le cas de vaccins de la grippe, Vaxigrip et Fluzone. Pour le premier il a été montré en 2012 qu’il augmentait chez des enfants de 6 à 15 ans le risque d’infection par d’autres virus respiratoires. Le second s’est avéré augmenter le risque d’infection par la grippe chez des adultes obèses (par rapport à des personnes non obèses elles-mêmes vaccinées). Plus récemment, en 2019, une étude révèle qu’un vaccin inactivé de la dengue augmente le taux d’infection par le même virus chez des macaques, ce qui avait déjà été observé auparavant avec un virus atténué chez des enfants non exposés à la dengue avant vaccination.
Des précautions toutes particulières doivent donc être prises avec des vaccins inactivés contre la Covid-19, d’autant plus que le virus qui en est responsable est totalement nouveau et que nous sommes loin d’en cerner tous les effets.
2. Vaccins contenant la protéine antigénique et vaccins à particule pseudo-virale
Outre le coût qu’ils représentent en raison de l’étape plus ou moins lourde de purification de la protéine virale à partir des cellules transgéniques qui la produisent, ces vaccins s’avèrent être peu efficaces et peuvent présenter des effets toxiques dus essentiellement aux adjuvants (tels que l’aluminium ou le formaldéhyde par exemple) ajoutés justement pour pallier la faible efficacité et donc potentialiser la stimulation du système immunitaire, mais également éventuellement à l’antigène lui-même qui, en étant produit par des cellules transgéniques (qui ne sont donc pas celles qui le produisent normalement) peut présenter des différences structurelles ou chimiques qui pourront lui conférer des propriétés inattendues.
En effet, si le message génétique contenu dans le gène viral (transgène) dicte aux cellules qui l’hébergent (cellules transgéniques), lors du processus de traduction, la nature et l’ordre d’enchaînement des acides aminés pour fabriquer la protéine virale (antigène), il n’est en revanche que très partiellement responsable de la manière dont la protéine doit se replier dans l’espace. Ce repliement dépend en partie de la nature et de l’ordre d’enchaînement des acides aminés (et donc du gène) mais essentiellement de l’environnement de la cellule dans laquelle la protéine est fabriquée (acidité, concentration en sels…). Or l’environnement cellulaire peut varier considérablement d’un type cellulaire à un autre, et on n’aura donc jamais la certitude que la protéine d’intérêt (ici l’antigène viral) est correctement repliée lorsqu’elle est artificiellement fabriquée par les cellules transgéniques, même lorsque cette protéine conserve l’activité biologique qui nous intéresse (ici, son caractère immunogène).
Le mauvais repliement d’une protéine peut avoir des conséquences absolument imprévisibles et parfois très fâcheuses. N’oublions pas que les maladies à prions, par exemple (maladie de la vache folle, maladie de Creutzfeldt-Jakob, tremblante du mouton, etc.), sont dues à de simples défauts de repliement d’une protéine particulière. Certes, tous les défauts de repliement ne font pas des prions…, mais prions pour que la protéine virale se replie bien.
Par ailleurs, une fois son repliement terminé, la protéine peut faire l’objet de modifications chimiques secondaires (dites « post-traductionnelles ») tels que des ajouts de sucres, de phosphates, qui peuvent être nécessaires à sa fonctionnalité, à son activité, ou lui conférer des propriétés particulières telles que — justement — des propriété immunogènes. Là encore, on n’aura jamais la certitude que ces modifications post-traductionnelles (qui ne sont pas « dictées » par le gène) mises en place dans les cellules transgéniques sont absolument identiques à ce qu’elles sont dans les cellules où la protéine est naturellement fabriquée (ici, les cellules naturellement infectées par le virus).
3. Les vaccins délivrant l’ARN ou l’ADN codant la protéine antigénique
3.1. Le risque d’apparition de virus recombinant
Ce risque est indépendant du vecteur utilisé pour délivrer dans les cellules de l’hôte l’ADN ou l’ARN viral codant l’antigène protéique, qu’il s’agisse d’un vecteur plasmidique, d’une nanoparticule ou d’un virus génétiquement modifié. Toutefois, ce risque est encore plus grand dans le cas du recours à des virus génétiquement modifiés car ceux-ci apportent non seulement l’ADN ou l’ARN viral d’intérêt mais également une partie de leur propre génome.
Les virus ont une grande capacité à échanger des fragments de leur matériel génétique respectif dès lors que les génomes viraux concernés sont de même nature (soit ADN, soit ARN) et qu’ils partagent des séquences (des gènes) qui se ressemblent. Le processus bien connu qui régit ces échanges s’appelle la recombinaison (et lorsque cette recombinaison a lieu entre séquences d’ADN ou d’ARN qui se ressemblent, on parle de recombinaison homologue). Ce phénomène de recombinaison n’est pas réservé à l’ADN ou l’ARN viral mais les séquences virales sont connues pour faire l’objet de nombreuses recombinaisons (on dit qu’elles sont très « recombinogènes »). Il résulte de ces recombinaisons, entre matériels génétiques viraux, des virus dits « recombinants » dont le ou les gène(s) qui a (ont) été le site de ces échanges sont dits « mosaïques », c’est-à-dire constitués en partie de séquences provenant du virus 1 et de séquences provenant du virus 2 (Figure 3). La Figure 3 illustre la recombinaison entre ADN viraux mais ce phénomène peut se produire tout aussi bien entre ARN viraux.
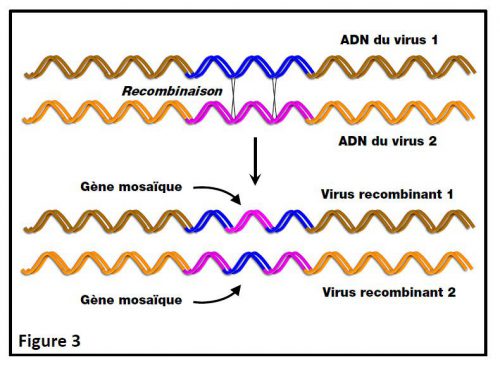 Dans un certain nombre de cas, ces virus recombinants sont beaucoup plus virulents que les virus d’origine et peuvent donc provoquer des viroses aggravées. Ce phénomène a été largement démontré chez des plantes transgéniques dans lesquelles un gène viral a été volontairement introduit dans leur génome, et infectées par un virus apparenté à celui d’où provient le transgène viral. Un exemple très médiatisé de virus recombinant pouvant provoquer des viroses aggravées chez l’humain est celui du virus H1N1 de 2009, recombinant entre trois souches de virus de la grippe : une souche porcine, une souche humaine et une souche aviaire.
Dans un certain nombre de cas, ces virus recombinants sont beaucoup plus virulents que les virus d’origine et peuvent donc provoquer des viroses aggravées. Ce phénomène a été largement démontré chez des plantes transgéniques dans lesquelles un gène viral a été volontairement introduit dans leur génome, et infectées par un virus apparenté à celui d’où provient le transgène viral. Un exemple très médiatisé de virus recombinant pouvant provoquer des viroses aggravées chez l’humain est celui du virus H1N1 de 2009, recombinant entre trois souches de virus de la grippe : une souche porcine, une souche humaine et une souche aviaire.
Bien sûr, ce phénomène ne peut se produire que si du matériel génétique provenant d’au moins deux virus se retrouve dans les mêmes cellules, ce qui est fort heureusement extrêmement rare dans la nature puisque cela implique que des mêmes cellules soient co-infectées par au moins deux virus. Mais sous l’effet de la main de l’homme, ce phénomène peut devenir beaucoup plus courant. C’est bien sûr le cas, comme mentionné précédemment, des plantes transgéniques dans lesquelles a été introduit un transgène viral où il suffit alors que ces plantes soient infectées par un seul virus pour que de tels évènements de recombinaison aient lieu. Mais c’est aussi le risque que l’on fait courir chez les humains dès lors que l’on génère des vaccins délivrant dans les cellules des patients de l’ARN ou de l’ADN viral.
Les vaccins anti-Covid-19 de ce type faisant l’objet d’essais cliniques sont administrés en intramusculaire ou en intradermique. Les cellules cibles sont donc des cellules musculaires, des cellules de la peau, des fibroblastes (cellules du tissu conjonctif, c’est-à-dire du tissu de soutien qui enveloppe les organes, les tissus, et notamment les faisceaux musculaires) mais aussi des cellules du sang circulant et des cellules endothéliales (qui tapissent les vaisseaux sanguins), autant de cellules qui peuvent être la cible d’infections par d’autres virus. Par exemple des entérovirus (virus nus à ARN) ont été détectés dans des cellules musculaires, le virus Zika infecte les cellules de la peau, le Chikungunya a pour cible les cellules musculaires satellites (cellules souches du tissu musculaire), mais aussi les cellules endothéliales et les fibroblastes. Et ce ne sont là sans doute que quelques exemples…
La vaccination contre le Covid-19 sera une vaccination de masse à travers le monde entier. La probabilité que ce genre d’évènements survienne est donc loin d’être nulle même si elle reste sans doute faible en termes de fréquence. Une telle vaccination de masse avec ce type de vaccins pourrait devenir une fabrique à grande échelle de nouveaux virus recombinants. N’oublions pas qu’il suffit qu’un seul nouveau virus apparaisse quelque part dans le monde pour que les conséquences sanitaires, environnementales, sociales, soient mondiales et colossales…
3.2. Le risque de mutagenèse insertionnelle (génotoxicité)
La mutagenèse insertionnelle est une mutation (modification de l’information génétique) par insertion d’une séquence à l’intérieur d’un génome, cette insertion pouvant alors inactiver ou modifier l’expression d’un ou plusieurs gène(s).
Ce risque de génotoxicité pour les cellules humaines cibles de la vaccination (dont le génome est bien sûr de l’ADN) ne concerne donc que les vaccins délivrant de l’ADN viral, que le vecteur soit un plasmide ou un virus génétiquement modifié. Toutefois, ce risque peut également concerner les vaccins délivrant de l’ARN par le biais d’un vecteur viral génétiquement modifié à ARN du type du virus du sida (VIH, très utilisé comme vecteur) si celui-ci n’a pas été correctement dépourvu de sa transcriptase inverse et du gène la codant. En effet, la transcriptase inverse virale peut alors convertir l’ARN délivré en ADN, lequel ira s’intégrer dans le génome des cellules cibles.
Les virus génétiquement modifiés sont également très utilisés à des fins de thérapies géniques pour délivrer dans ce cas la version normale d’un gène humain qui s’avère défaillant (muté) chez le patient traité. En 2002, trois ans après un essai de thérapie génique (chez des enfants atteints d’une immunodéficience sévère due à une mutation sur un gène du chromosome X) utilisant un virus à ARN génétiquement modifié comme vecteur, deux des 10 enfants traités ont développé une leucémie due à l’insertion de l’ADN réparateur délivré par le vecteur viral à proximité d’un proto-oncogène (gène de cancer), provoquant une perturbation sévère de l’expression de celui-ci.
Plusieurs études ont montré les effets de mutagenèse insertionnelle provoqués par différentes familles de virus à ARNs (dont le VIH). De même, plusieurs études réalisées chez des souris ont montré que la délivrance de gènes par des vecteurs dérivés du virus adéno-associé (AAV, petit virus à ADN non pathogène) résultent en une mutagenèse insertionnelle. En 2016, une étude sur les effets génotoxiques des vecteurs viraux dérivés du VIH et du AAV, utilisés à des fins de thérapie génique, conclut que « une connaissance approfondie de la biologie virale et des progrès en génétique cellulaire sont nécessaires pour élucider la nature de la sélection des sites d’intégration des vecteurs viraux et les risques associés ».
4. Risques spécifiquement liés à l’utilisation de vecteur viraux modifiés : immunotoxicité
 Outre les risques d’apparition de virus recombinants et de mutagenèse insertionnelle (surtout lorsque le matériel génétique délivré est de l’ADN), les vecteurs viraux étant eux-mêmes immunogènes, ils peuvent engendrer d’importants effets d’immunotoxicité.
Outre les risques d’apparition de virus recombinants et de mutagenèse insertionnelle (surtout lorsque le matériel génétique délivré est de l’ADN), les vecteurs viraux étant eux-mêmes immunogènes, ils peuvent engendrer d’importants effets d’immunotoxicité.
En 2002, une expérience pilote de thérapie génique, réalisée chez 18 garçons souffrant d’un grave trouble métabolique dû à un gène défaillant situé sur le chromosome X, a conduit au décès d’un jeune homme de 18 ans en raison d’une réponse inflammatoire systémique fatale provoquée par le vecteur viral (virus à ADN humain désarmé) : des séquences d’ADN du vecteur ont été retrouvées dans la plupart de ses tissus. Le fait que les 17 autres individus traités n’ont absolument pas manifesté ce type de réponse montre à quel point ce risque est difficilement prévisible et donc maîtrisable.
En Belgique, plusieurs essais cliniques d’immunothérapie pour lutter contre des cancers et utilisant un virus désarmé où plus de 15% de son génome a été remplacé par deux gènes humains (codant un antigène présent à la surface des cellules cancéreuses et une interleukine, protéine de communication entre cellules immunitaires) ont montré une activation non spécifique du système immunitaire liée au vecteur résultant en une réaction inflammatoire et une réponse auto-immune.
De nombreux autres études ont montré des effets d’immunotoxicité de divers vecteurs viraux utilisés à des fins de thérapie génique ou de vaccination. Dans le cas des vecteur viraux utilisés à des fins de vaccination, l’immunité anti-vecteur peut aussi directement interférer avec l’efficacité vaccinale recherchée (l’immunogénicité du vaccin).
V. Considérations générales relatives à l’évaluation des risques liés à ces vaccins
Le recours à des vaccins délivrant du matériel génétique viral (ADN ou ARN) est nouveau ou récent. L’utilisation de virus génétiquement modifiés comme vecteurs, notamment à des fins de thérapie génique ou d’immunothérapie a montré à quel point les effets indésirables sont variés, non maîtrisés et peuvent être graves. Si les tentatives de l’immunothérapie sont relativement récentes, les échecs de la thérapie génique depuis près de 35 ans sont là pour nous le rappeler. Ces échecs s’expliquent en grande partie par la recherche du scoop au détriment de l’efficacité et/ou la biosécurité. Une telle démarche ne permettra jamais de répondre à l’attente et aux besoins en termes de soin.
Mais l’utilisation de ces mêmes vecteurs à des fins de vaccination revêt encore une autre dimension. En effet, la thérapie génique ou l’immunothérapie concernent non seulement un nombre limité de personnes mais des personnes gravement malades. Par conséquent, non seulement les éventuels effets secondaires concernent un nombre restreint d’individus mais la gravité de leur état de santé et la situation d’urgence sanitaire dans laquelle ils se trouvent permet sans doute d’accepter une certaine prise de risques.
Dans le cas de vaccins, nous sommes dans une démarche de prévention. Cela concerne donc un nombre considérable de personnes dont la grande majorité est en bonne santé (en tout cas vis-à-vis de la pathologie de laquelle le vaccin est censé nous protéger). Des effets secondaires non maîtrisés auraient donc des retombées considérables, surtout dans une campagne de vaccination de masse telle que celle destinée à lutter contre la Covid-19. Ces retombées pourraient être désastreuses sur le plan sanitaire bien sûr mais également sur le plan environnemental (dans le cas par exemple de la propagation de nouveaux virus recombinants : voir section IV. 3.1.) Et le fait qu’il s’agisse d’une démarche de prévention n’autorise aucune prise de risque.
Par conséquent, ces candidats vaccins nécessitent une évaluation sanitaire et environnementale approfondie incompatible avec l’urgence, qu’il s’agisse de celle résultant de la pression des autorités décisionnelles et sanitaires ou celle des profits des industries pharmaceutiques embarquées dans cette course au vaccin. Dans sa note de cadrage du 23 juillet 2020 sur la stratégie vaccinale contre la Covid-19, la Haute Autorité de Santé (HAS) déclare : « Dans le cadre de la pandémie de Covid-19, l’enjeu est donc de concevoir un vaccin le plus efficace et le plus sûr possible en un temps record ». Cette allégation est un non-sens et une aberration de la part d’une autorité telle que la HAS.
Les dangers liés aux caractéristiques des vecteurs viraux génétiquement modifiés ou à leur éventuelle dispersion ou dissémination doivent être traités dans le cadre d’une évaluation des risques environnementaux extrêmement contraignante.
Au contraire, les articles 2 et 3 du tout récent règlement européen 2020/1043 selon lesquels tout essai clinique de médicaments contenant des OGM ou consistant en de tels organismes et destinés à traiter ou à prévenir la Covid-19 échappe aux évaluations préalables sur la santé et l’environnement ouvre la porte au plus grand laxisme en termes d’évaluation et va totalement à l’encontre du principe de précaution.
De plus, ce règlement, remet en cause, de fait, la législation de confinement qui s’applique aux micro-organismes et aux virus génétiquement modifiés. Cette réglementation définit 4 niveaux de confinement (identifiés de 1 à 4, le confinement étant d’autant plus contraignant que le chiffre est plus élevé). La manipulation de virus pathogènes exige un confinement minimal de 2, très souvent de 3, voire 4. Les dispositions du règlement 2020/1043 ouvrent la porte à un confinement zéro avant même d’avoir apporté la preuve de la sécurité sanitaire et environnementale des virus génétiquement modifiés en question.
yogaesoteric
29 mars 2021
